AMMONIA
Ammonia merupakan sumber yang membekalkan unsur nitrogen. Ammonia dihasilkan melalui tindak balas antara gas nitrogen dan gas hidrogen. Unsur nitrogen penting untuk tumbesaran tumbuh-tumbuhan.
Ammonia wujud dalam 3 bentuk :
- Garam ammonium yang dihasilkan daripada tindak balas antara ammonia dengan asid.
- Asid nitrik yang dihasilkan daripada pengoksidaan ammonia.
- Garam nitrat yang diperoleh daripada asid nitrik melalui tindak balas kimia.
Garam ammonium, asid nitrik dan garam nitrat merupakan bahan mentah yang penting dalam industri pembuatan pelbagai jenis bahan kimia yang berasaskan nitrogen.
KEGUNAAN AMMONIA
KEGUNAAN UTAMA AMMONIA : Penghasilan baja bernitrogen termasuklah ammonium sulfat (NH4)2SO4, ammonium nitrat NH4NO3, ammonium fosfat (NH4)3PO4 dan urea CO(NH2)2.
KEGUNAAN UTAMA AMMONIA : Penghasilan baja bernitrogen termasuklah ammonium sulfat (NH4)2SO4, ammonium nitrat NH4NO3, ammonium fosfat (NH4)3PO4 dan urea CO(NH2)2.
- Membuat baja kimia.
- Membuat bahan letupan.
- Membuat gentian sintetik.
- Membuat asid nitrik.
- Sebagai agen penyejuk.
- Mencegah pembekuan susu getah.
- Membuat bahan pencuci.
SIFAT SIFAT AMMONIA
Sifat Fizik
- Bersifat alkali
- Berbau sengit
- Gas tak berwarna
- Sangat larut didalam air
- Kurang tumpat daripada udara
Sifat Kimia
- Ammonia bertindak balas dengan gas hidrogen klorida untuk menghasilkam wasap putih ammonium klorida yang tebal
- Ammonia meneutralkan pelbagai jenis asid untuk menghasilkan garam ammonium
- Ion hidroksida daripada larutan ammonia bertindak balas dengan ion logam untuk menghasilkan mendakan hidroksida logam
- Ammonia terbakar dalam oksigen tetapi tidak terbakar dalam udara
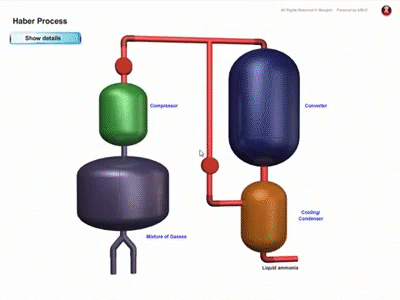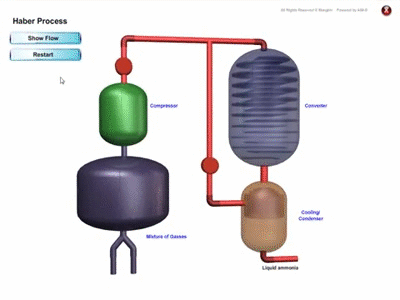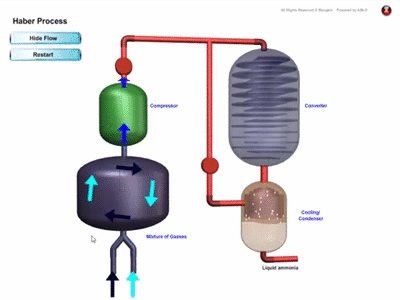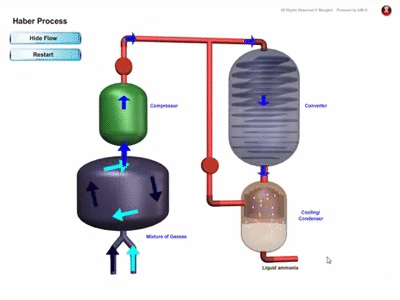
PROSES PEMBUATAN AMMONIA SECARA INDUSTRI
- Ammonia dihasilkan di kilang secara besar-besaran melalui Proses Haber dengan menggunakan gas nitrogen dan gas hidrogen
- Rajah menunjukkan penghasilan ammonia melalui proses Haber :
Proses Haber
- Gas nitrogen diperoleh melalui proses penyulingan berperingkat ke atas udara cecair.
- Gas hidrogen diperoleh daripada gas asli.
- Nisbah 1 mol gas nitrogen kepada 3 mol gas hidrogen dialirkan ke dalam sebuah reaktor.
- Campuran gas ini dimampatkan di bawah tekanan 200 atmosfera pada suhu 450 ℃ hingga 550 dan dimangkinkan dengan serbuk besi bagi mempercepatkan tindak balas.
- Ammonia yang terhasil disejukkan menjadi cecair dan diasingkan daripada gas hidrogen dan gas nitrogen yang belum lagi bertindak balas. Gas-gas ini dikitar semula fengan mengalirkan ke dalam reaktor bersama dengan bersama gas nitrogen dan gas hidrogen yang baharu untuk tindak balas selanjutnya.
FAKTOR-FAKTOR YANG MEMPENGARUHI PENGHASILAN GARAM AMMONIA
- · Terdapat tiga faktor yang mempengaruhi penghasilan ammonia secara optimum
AKTIVITI MENYEDIAKAN BAJA AMMONIUM
Aktiviti :
Penyediaan Baja Ammonium Sulfat
Tujuan: Menyediakan baja ammonium sulfat
Bahan:
» Kertas litmus merah
» Larutan ammonia 2mol dm-3
» Asid sulfurik cair 1mol dm-3
» Air suling
» Kertas turas
Radas:
» Bikar 100cm3
» Rod kaca
» Tungku kaki tiga
» Penunu Bunsen
» Kasa dawai
» Corong turas
» Silinder penyukat
» Mangkuk penyejat
Prosedur:
1. 25cm3 asid sulfurik disukat dengan silinder penyukat. Asid ini dituang ke dalam bikar 100cm3.
2. Larutan ammonia dititis setitik demi setitik ke dalam bikar itu sementara larutan dikacau dengan rod kaca.
3. Larutan yang terhasil diuji dengan kertas litmus merah dari semasa ke semasa. Penitisan larutan ammonia dihentikan sekiranya kertas litmus bertukar kepada biru (atau semasa larutan mengeluarkan bau ammonia).
4. Kemudian, larutan dituang ke dalam mangkuk penyejat.
5. Larutan dididihkan sehingga tepu.
6. Larutan tepu disejukkan pada suhu bilik. Hablur-hablur putih ammonium sulfat akan terbentuk.
7. Hablur-hablur garam itu dituras dan dibilas dengan air suling yang sejuk.
8. Hablur-hablur yang terbentuk dikeringkan dengan kertas turas.
Persamaan kimia:
H2SO4(ak) + 2NH3(ak) → (NH4)2SO4(ak)
Analisis:
► Larutan ammonia adalah berlebihan ketika kertas litmus merah mula bertukar warna.
► Larutan tepu perlu disejukkan pada suhu bilik supaya penghabluran dapat berlaku.
► Hablur-hablur garam dibilas dengan sedikit air suling yang sejuk untuk menyingkirkan bendasing seperti larutan ammonia.
Kesimpulan:
► Baja ammonium sulfat dapat disediakan melalui tindak balas antara larutan ammonia dengan asid sulfurik cair, dan kemudiannya melalui penghabluran.
Aktiviti :
Penyediaan Baja Ammonium Sulfat
Tujuan: Menyediakan baja ammonium sulfat
Bahan:
» Kertas litmus merah
» Larutan ammonia 2mol dm-3
» Asid sulfurik cair 1mol dm-3
» Air suling
» Kertas turas
Radas:
» Bikar 100cm3
» Rod kaca
» Tungku kaki tiga
» Penunu Bunsen
» Kasa dawai
» Corong turas
» Silinder penyukat
» Mangkuk penyejat
Prosedur:
1. 25cm3 asid sulfurik disukat dengan silinder penyukat. Asid ini dituang ke dalam bikar 100cm3.
2. Larutan ammonia dititis setitik demi setitik ke dalam bikar itu sementara larutan dikacau dengan rod kaca.
3. Larutan yang terhasil diuji dengan kertas litmus merah dari semasa ke semasa. Penitisan larutan ammonia dihentikan sekiranya kertas litmus bertukar kepada biru (atau semasa larutan mengeluarkan bau ammonia).
4. Kemudian, larutan dituang ke dalam mangkuk penyejat.
5. Larutan dididihkan sehingga tepu.
6. Larutan tepu disejukkan pada suhu bilik. Hablur-hablur putih ammonium sulfat akan terbentuk.
7. Hablur-hablur garam itu dituras dan dibilas dengan air suling yang sejuk.
8. Hablur-hablur yang terbentuk dikeringkan dengan kertas turas.
Persamaan kimia:
H2SO4(ak) + 2NH3(ak) → (NH4)2SO4(ak)
Analisis:
► Larutan ammonia adalah berlebihan ketika kertas litmus merah mula bertukar warna.
► Larutan tepu perlu disejukkan pada suhu bilik supaya penghabluran dapat berlaku.
► Hablur-hablur garam dibilas dengan sedikit air suling yang sejuk untuk menyingkirkan bendasing seperti larutan ammonia.
Kesimpulan:
► Baja ammonium sulfat dapat disediakan melalui tindak balas antara larutan ammonia dengan asid sulfurik cair, dan kemudiannya melalui penghabluran.

No comments:
Post a Comment